BENZENA DAN TURUNANNYA
A.Struktur Benzena
Struktur benzena pertama kali diperkenalkan oleh Kekule pada tahun 1865.
Menurutnya, keenam atom karbon pada benzena tersusun secara melingkar membentuk
segi enam beraturan dengan sudut ikatan masing-masing 120 derajat. Ikatan
antara karbon adalah ikatan rangkap dua dan ikatan tunggal yang berselang
seling.
Benzena termasuk senyawa aromatik dan memiliki rumus molekul C6H6.
Rumus molekul benzena memperlihatkan sifat ketakjenuhan dengan adanya ikatan rangkap. Tetapi ketika dilakukan
uji bromin benzena tidak memperlihatkan sifat ketakjenuhan karena
benzena tidak melunturkan warna dari air bromin.
Berdasarkan hasil analisis, ikatan rangkap dua karbon-karbon pada benzena
tidak terlokalisasi pada karbon tertentu melainkan dapat berpindah-pindah.
Gejala ini disebut resonansi. Adanya
resonansi pada benzena ini menyebabkan ikatan pada benzena menjadi stabil,
sehingga ikatan rangkapnya tidak dapat diadisi oleh air brom.
B.Resonansi
Resonansi
terjadi karena adanya delokalisasi elektron dari ikatan rangkap ke ikatan
tunggal. Struktur Resonansi
Benzena:
Resonansi
terjadi karena adanya delokalisasi elektron dari ikatan rangkap ke ikatan
tunggal. Delokalisasi elektron yang terjadi pada benzena pada struktur
resonansi adalah sebagai berikut:
Hal yang
harus diperhatikan adalah, bahwa lambang resonasi bukan struktur nyata dari
suatu senyawa, tetapi merupakan struktur khayalan. Sedangkan struktur nyatanya
merupakan gabungan dari semua struktur resonansinya. Hal ini pun berlaku dalam
struktur resonansi benzena, sehingga benzena lebih sering digambarkan sebagai berikut:
Teori
resonansi dapat menerangkan mengapa benzena sukar diadisi. Sebab, ikatan rangkap
dua karbon-karbon dalam benzena terdelokalisasi dan membentuk semacam cincin
yang kokoh terhadap serangan kimia, sehingga tidak mudah diganggu. Oleh karena
itulah reaksi yang umum pada benzena adalah reaksi substitusi terhadap atom H
tanpa mengganggu cincin karbonnya.
Hal yang
harus diperhatikan adalah, bahwa lambang resonasi bukan struktur nyata dari
suatu senyawa, tetapi merupakan struktur khayalan. Sedangkan struktur nyatanya
merupakan gabungan dari semua struktur resonansinya.
Hal ini pun berlaku dalam
struktur resonansi benzena. Teori resonansi dapat menerangkan mengapa benzena
sukar diadisi. Sebab, ikatan rangkap dua karbon-karbon dalam benzena
terdelokalisasi dan membentuk semacam cincin yang kokoh terhadap serangan
kimia, sehingga tidak mudah diganggu. Oleh karena itulah reaksi yang umum pada
benzena adalah reaksi substitusi terhadap atom H tanpa mengganggu cincin
karbonnya.
Sifat
fisik benzena yaitu:
1.
Zat cair tidak berwarna
2.
Memiliki bau yang khas
3.
Mudah menguap
4.
Tidak larut dalam pelarut polar seperti air, tetapi
larut dalam pelarut yang kurang polar atau non polar, seperti eter dan
tetraklorometana
5.
Titik Leleh : 5,5 derajat Celsius
6.
Titik didih : 80,1derajat Celsius
7.
Densitas : 0,88
D. Sifat Kimia
1.
Bersifat kasinogenik (racun)
2.
Merupakan senyawa nonpolar
3.
Tidak begitu reaktif, tapi mudah terbakar dengan
menghasilkan banyak jelaga
4.
Lebih mudah mengalami reaksi substitusi dari pada
adisi.
E. Reaksi-reaksi pada Benzena
Benzena merupakan senyawa yang kaya akan elektron,
sehingga jenis pereaksi yang akan menyerang cincin benzena adalah pereaksi yang
suka elektron. Pereaksi seperti ini disebut elektrofil. Contohnya adalah
golongan halogen dan H2SO4.
1.
Halogenasi
Halogenasi merupakan reaksi substitusi atom H pada benzena oleh golongan
halogen seperti F, Cl, Br, I. Pada reaksi ini atom H digantikan oleh atom dari
golongan halogen dengan bantuan katalis besi (III) halida. Jika halogennya Cl2,
maka katalis yang digunakan adalah FeCl3. Contoh:
2.
Nitrasi
Nitrasi merupakan reaksi substitusi atom H pada benzena oleh gugus nitro.
Reaksi ini terjadi dengan mereaksikan benzena dengan asam nitrat (HNO3)
pekat dengan bantuan H2SO4 sebagai katalis. Reaksi yang terjadi
adalah sebagai berikut:
3.
Sulfonasi
Sulfonasi merupakan reaksi substitusi atom H pada benzena oleh gugus
sulfonat. Reaksi ini terjadi apabila benzena dipanaskan dengan asam sulfat
pekat sebagai pereaksi.
4.
Alkilasi–Friedel Craft
Alkilbenzena dapat terbentuk jika benzena direaksikan dengan alkil halida
dengan katalis alumunium klorida (AlCl3).
F. Senyawa Turunan Benzena
Kemudahan benzena mengalami reaksi substitusi
elektrofilik menyebabkan benzena memiliki banyak senyawa turunan. Semua senyawa
karbon yang mengandung cincin benzena digolongkan sebagai turunan benzena.
Berikut ini beberapa turunan benzena yang umum:
Toluena
Toluena digunakan sebagai pelarut dan sebagai bahan dasar untuk membuat TNT
(trinitotoluena), senyawa yang digunakan sebagai bahan peledak (dinamit).
Stirena
Stirena digunakan sebagai bahan dasar pembuatan polimer sintetik polistirena
melalui proses polimerisasi. Polistirena banyak digunakan untuk membuat
insolator listrik, boneka, sol sepatu serta piring dan cangkir.
Anilina
Anilina
merupakan bahan dasar untuk pembuatan zat-zat warna diazo. Anilina dapat diubah
menjadi garam diazonium dengan bantuan asam nitrit dan asam klorida.
Garam
diazonium selanjutnya diubah menjadi berbagai macam zat warna. Salah satu
contohnya adalah Red No.2 yang memiliki struktur sebagai berikut:
Red No.2
dulunya digunakan seabagai pewarna minuman, tetapi ternyata bersifat sebagai
mutagen. Oleh karena itu, sekarang Red No.2 digunakan sebagai pewarna wol dan
sutera.
Fenol
Dalam
kehidupan sehari-hari fenol dikenal sebagai karbol atau lisol yang berfungsi
sebagai zat disenfektan.
Benzaldehida
Benzaldehida
digunakan sebagai zat pengawet serta bahan baku pembuatan parfum karena memiliki
bau yang khas. Benzaldehida dapat berkondensasi dengan asetaldehida (etanal),
untuk menghasilkan sinamaldehida (minyak kayu manis).
Asam Benzoat dan Turunannya
Terdapat
beberapa turunan dari asam benzoat yang tanpa kita sadari sering kita gunakan,
diantaranya adalah:
- Asam asetil salisilat atau lebih dikenal dengan sebutan aspirin atau asetosal yang biasa digunakan sebagai obat penghilang rasa sakit (analgesik) dan penurun panas (antipiretik). Oleh karena itu aspirin juga digunakan sebagai obat sakit kepala, sakit gigi, demam dan sakit jantung. Penggunaan dalam jangka panjang dapat menyebabkan iritasi lapisan mukosa pada lambung sehingga menimbulkan sakit maag, gangguan ginjal, alergi, dan asma.
- Natrium benzoat yang biasa ggunakan sebagai pengawet makanan dalam kaleng.
- Metil salisilat adalah komponen utama obat gosok atau minyak angin.
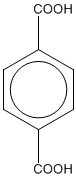
- Asam tereftalat merupakan bahan serat sintetik polyester.
- Parasetamol (asetaminofen) memiliki fungsi yang sama dengan aspirin tetapi lebih aman bagi lambung. Hampir semua obat yang beredar dipasaran menggunakan zat aktif parasetamol. Penggunaan parasetamol yang berlebihan dapat menimbulkan gangguan ginjal dan hati.
Selain
senyawa-senyawa di atas, masih banyak lagi senyawa turunan benzena yang
terdapat di sekitar kita baik itu dengan satu substituen yang terikat pada
cincin benzena, ataupun dua substituen atau lebih.
G. Tatanama Senyawa Turunan Benzena
Semua senyawa yang mengandung cincin
benzena digolongkan
sebagai senyawa turunan benzena. Penataan nama senyawa turunan benzena sama seperti
pada senyawa alifatik, ada tata nama umum (trivial) dan tata nama menurut IUPAC
yang didasarkan pada sistem penomoran. Dengan tata nama IUPAC, atom karbon
dalam cincin yang mengikat substituen diberi nomor terkecil.
Menurut IUPAC, benzena dengan satu substituen
diberi nama seperti pada senyawa alifatik, sebagai gugus induknya adalah
benzena. Contoh :
Benzena
dengan gugus alkil sebagai substituen, diklasifikasikan sebagai golongan arena.
Penataan nama arena dibagi ke dalam dua golongan berdasarkan panjang rantai
alkil. Jika gugus alkil berukuran kecil (atom C < 6) maka gugus alkil
diambil sebagai substituen dan benzena sebagai induknya. Contoh :
Jika
gugus alkil berukuran besar (atom C > 6) maka benzena dinyatakan sebagai
substituen dan alkil sebagai rantai induknya. Benzena sebagai substituen diberi
nama fenil– (C6H5–, disingkat –ph). Contoh:
Benzena dengan dua gugus substituen
diberi nama dengan awalan: orto– (o–), meta– (m–), dan para– (p–). Orto–
diterapkan terhadap substituen berdampingan (posisi 1 dan 2), meta– untuk
posisi 1 dan 3, dan para– untuk substituen dengan posisi 1 dan 4.
Tabel 1. Beberapa Sifat Fisika dari Molekul o, m,
p–hidroksimetilbenzena
Nama
|
Titik Beku (°C)
|
Titik Didih (°C)
|
o–hidroksimetilbenzena
|
31
|
191
|
m–hidroksimetilbenzena
|
12
|
203
|
p–hidroksimetilbenzena
|
35
|
202
|
Jika gugus substituen sebanyak tiga atau lebih, penataan nama menggunakan penomoran dan ditulis secara alfabet. Nomor terkecil diberikan kepada gugus fungsional (alkohol, aldehida, atau karboksilat) atau gugus dengan nomor paling kecil.
Di samping
tata nama menurut IUPAC, juga terdapat beberapa nama yang sudah umum (trivial),
misalnya:
Tata nama
trivial sering kali dipakai sebagai nama induk dari benzena. Penomoran untuk
senyawa seperti ini dimulai dari gugus fungsional. Contoh :
- Benzena pada umumnya dipakai sebagai induk dan gugus yang terikat disebutkan lebih dulu kemudian diikuti dengan benzena.
Contoh :
Beberapa
senyawa turunan benzena mempunyai nama khusus yang lebih lazim digunakan.
- Untuk dua subtituen posisinya dapat diberi awalan : orto (o) untuk posisi 1 dan 2, meta (m) untuk posisi 1 dan 3 dan para (p) untuk posisi 1 dan 4. Perhatikan contoh-contoh berikut:
- Gugus bervalensi satu yang diturunkan dari benzena disebut fenil dan gugus yang diturunkan dari toluena disebut benzil.
- Untuk tiga substituen atau lebih, awalan orto, meta, dan para tidak diterapkan lagi, tetapi posisi substituen yang dinyatakan dengan angka, urutan prioritas penomoran adalah sebagai berikut: – COOH, – SO3H, – CHO, – CN, – OH, – NH2, – R, – NO2, – X
- Bila cincin benzena terikat pada rantai alkana bergugus fungsi atau rantai alkana dengan 7 atom karbon atau lebih maka rantai alkana tersebut sebagai induk, sedangkan cincin benzena sebagai substituen.
H. Kegunaan Benzena dan Turunannya
Berikut ini tabel manfaat atau
kegunaan dari beberapa senyawa turunan benzena:
No.
|
Turunan Benzena
|
Manfaat
|
1.
|
Toluena
(metil benzena) |
- bahan
pembuatan asam benzoat
- bahan pembuat TNT (trinitro toluena) - pelarut senyawa karbon |
2.
|
Asam
Benzoat (karboksilatbenzena)
|
- pengawet
makanan
- bahan baku pembuatan Fenol |
3.
|
Fenol
(hidroksibenzena / fenil alkohol)
|
- Zat
antiseptik
- zat disinfektan - Pembuatan pewarna - resin |
4.
|
Trinitro Toluen
(TNT)
|
-bahan
peledak
|
5.
|
Trinitro
benzena (TNB)
|
- bahan
peledak
|
6.
|
Nitro
benzena
|
- pewangi
pada sabun
- pembuatan anilin |
7.
|
Anilin
(aminobenzena / fenil amina)
|
-
obat-obatan - bahan peledak
- bahan dasar zat warna diazo |
9.
|
Stirena
|
- bahan pembuatan
plastik dan karet sintetis
|
9.
|
Asam
salisilat
|
- bahan
obat / zat analgesik (aspirin)
- obat penyakit kulit |
10.
|
Asam
tereftalat
|
-bahan
serat sintetik polyester
|
11.
|
Parasetamol
(asetaminofen)
|
- obat
penurun panas
|
12.
|
Benzal
dehida
|
- zat
aditif penambah aroma makanan
|
13.
|
Benzil
alkohol
|
- bahan
pelarut
|
14.
|
Halogen
benzena
|
-
digunakan pada pembuatan cat dan pembuatan insektisida.
|
15.
|
Asam
benzena sulfonat
|
-
pembuatan obat
-pemanis buatan (sakarin termasuk turunan asam benzena sulfonat) |
I. Dampak Benzena
Telah disebutkan bahwa benzena memiliki sifat racun atau kasinogenik, yaitu
zat yang dapat membentuk kanker dalam tubuh manusia jika kadarnya dalam tubuh
manusia berlebih. Beberapa penelitian menunjukan bahwa benzena merupakan salah
satu penyebab leukemia, penyakit kanker darah yang telah banyak menyebabkan
kematian.
Dampak kesehatan akibat paparan Benzena berupa
depresi pada sistim saraf pusat hingga kematian. Paparan Benzena antara 50–150
ppm dapat menyebabkan sakit kepala, kelesuan, dan perasaan mengantuk.
Konsentrasi Benzena yang lebih tinggi dapat menyebabkan efek yang lebih parah,
termasuk vertigo dan kehilangan kesadaran. Paparan sebesar 20.000 ppm selama 5
– 10 menit bersifat fatal dan paparan sebesar 7.500 ppm dapat menyebabkan
keracunan jika terhirup selama 0,5 – 1 jam. Dampak yang ringan dapat berupa
euforia, sakit kepala, muntah, gaya berjalan terhuyung-huyung, dan pingsan.
Sumber:



























Tidak ada komentar:
Posting Komentar